 病因
病因
病因:幼儿大多与遗传有关,年长儿多继发于免疫性疾病、毒物或药物中毒以及各种肾脏病。
1.原发性(原因不明或无全身性疾病) 包括遗传性常染色体显性(AD)、常染色体隐性(AR)、X连锁隐性(XLR)、散发性、特殊型(即刷状缘缺失型)。
2.继发性(症状型)
(1)先天性代谢障碍:
①氨基酸代谢障碍:
A.胱氨酸病(常染色体隐性,AR)。
B.酪氨酸血症Ⅰ型(AR)。
C.Busby综合征(AR)。
D.Luder sheldon综合征(AD)。
②碳水化合物代谢障碍:
C.遗传性果糖不耐受症(AR)。
③其他:
A.Lowe综合征(XLR)。
B.肝豆状核变性(AR)。
C.细胞色素C氧化酶缺陷(AR)。
D.Dent病(家族性近端肾小管疾病,XLR)。
F.维生素B12缺乏。
(3)药物损伤及中毒如:①重金属(汞、钠、铅、镉);②化学毒剂马来酸、来苏儿、甲苯、甲酚、硝苯等;③过期四环素、丙酸;④顺铂、IFostamide、氨基糖苷类抗生素、维生素中毒;⑤雷米替丁、西米替丁、中草药如马兜铃肾损害等。
 发病机制
发病机制
发病机制:
1.发病机制 本病发病机制尚未完全清楚,有以下几种可能:
(1)内流缺陷:管腔内向组织内流减少,见于刷状缘缺失型。
(2)细胞内回漏到肾小管腔增加:如马来酸中毒型。
(3)回流减少:通过基底侧细胞膜回流减少,致细胞内物质堆积;影响回吸收,如Fanconi-Bickel综合征。
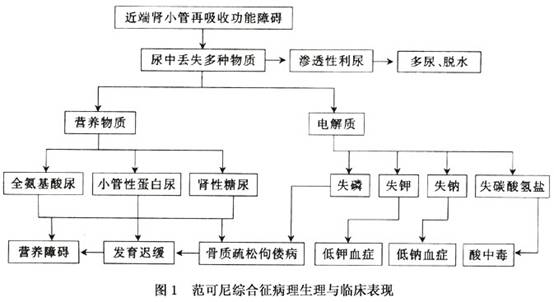
(4)灌注增加:从血液向细胞灌注增加,通过细胞紧密连结处反流管腔增加,如细胞色素C氧化酶缺乏型。肾小管膜的输送异常在病理组织学检查中未见特异性表现。有实验提示本征的细胞内ATP活性的转运功能不全是由于磷酸盐耗竭,引起细胞内腺嘌呤核苷酸降解,因而发生ATP消耗。本症的病理生理学改变见图1。
2.病理与病理生理 随着分子生物学的研究进展,已认识到
FA的发生是一个复杂的病理生理过程,DNA损伤识别或修复缺陷是
FA发生的关键,由于DNA的异常启动了相关的病理机制。
(1)DNA交联修复缺陷:
FA细胞对能产生链内和链间交联的双功能交联剂(如DEB、MMC、氮芥、环磷酰胺、顺铂等)敏感。DEB和MMC诱导的链内交联修复使DNA链切开,双链DNA同时损伤则没有可用的模板进行修复,需通过非同源末端连接(NHEJ)修复。在
FA细胞,非同源重组修复的保真性下降,导致细胞缺陷。相反,通过姊妹染色单体互换的同源重组在
FA没有缺陷。除了NHEJ异常,DNA损伤的识别也是受损的,使
FA细胞在复制完成以后阻滞在G
2期检查点。
(2)
FA细胞对氧的超敏性:一种理论认为,
FA细胞是被蓄积的氧自由基损伤的,这些氧自由基是由以下诱变剂产生的,如:高氧张力、γ-射线、诱裂剂和产生活性氢氧根的药物。
FA细胞红细胞过氧化物歧化酶(SOD)的水平降低,而白细胞SOD的浓度正常。也有红细胞SOD、过氧化氢酶和谷胱甘肽过氧化酶水平正常而谷胱甘肽转移酶水平上升的报道。在
FA,成纤维细胞SOD的水平正常,Mn-SOD、过氧化氢酶和谷胱甘肽过氧化酶的浓度增加,因此有人提出氧化剂的作用可能限于造血系统。SOD或过氧化氢酶加入到
FA的淋巴细胞培养中能减少断裂的数量,其他的研究者发现SOD、过氧化氢酶或半胱氨酸可减少MMC诱导的断裂。在高氧张力的情况下培养淋巴细胞导致一些
FA细胞的任意断裂的数量增加,正常细胞和加入MMC后的所有
FA细胞均没有增加。Clarke等研究了
FA细胞的凋亡,显示在5%氧浓度时暴露在MMC中与正常细胞相同,当20%氧浓度时则对MMC超敏,暗示对
FA细胞的毒性作用是MMC产生的氧反应产物(ROS)引起的,而不是DNA交联形成。
FA的氧敏感性涉及控制ROS过度产生的复杂系统或耐受氧诱导损害的能力,除线粒体外,细胞内产生ROS很大程度上是由于细胞色素P450酶系统,有研究表明
FANCC蛋白与NADPH细胞色素P450还原酶、
FANCG蛋白与细胞色素P4502E1(CYP2E1)之间相互作用,这两种酶都产生R0S。低氧张力和抗氧化剂被用于改善生长和减少
FA细胞任意或MMC诱导的染色体断裂。
(3)细胞周期调控异常:
FA细胞生长缓慢,G
2期延长。对类人猿病毒40(SV40)或
腺病毒12的转换是敏感的并表达SV40T抗原。不管是任意的或诱变剂治疗后,
FA细胞的姊妹染色单体互换一般不增加。在体外交联中
FA细胞是低突变的,与正常细胞一样,主要的突变是缺失而不是点突变。
FA细胞在细胞周期调控中有缺陷,G
2/M期转换延迟,这进一步增加了交联剂或高氧浓度的暴露。G
2/M检查点与基因组的监视和进入有丝分裂前的损伤修复有关,
FA细胞存在同源性重组增加和非同源性终末连接缺陷,
FA细胞不能有效的修复DNA损伤,因而停滞在G
2期。G
2期阻滞能被细胞周期蛋白家族中的一种SPHAR的过度表达以及咖啡因矫正,后者活化了周期依赖性激酶cdc2和废弃了一个G
2的检查点。
(4)细胞凋亡和端粒维持:许多研究显示
FA细胞凋亡调节异常,在一个研究中,4个
FA淋巴细胞系加入MMC治疗导致了凋亡增加,但其他的研究显示
FA细胞的
自发凋亡增加,γ射线照射时凋亡减少,而加入MMC后凋亡没有变化。凋亡的增加可能与
FA细胞修复损伤的能力有关,也可能在凋亡途径中,
FA蛋白与其他蛋白相互作用的缺陷有关。
FA细胞中可检测到端粒缩短加速,但在其他类型的AA和MDS中也存在。这可能是由于一个造血干细胞经过多于正常的细胞分裂次数而产生成熟细胞之缘故。最近的研究显示,除了端粒复制缩短,在
FA细胞的端粒序列也有较高的断裂发生,提示端粒维持缺陷。
(5)造血缺陷:
FA的造血缺陷被证明在祖细胞水平。伴AA和不伴有AA的
FA患者,从骨髓CFU-GM,CFU-E,BFU-E和血BFU-E来源的克隆均减少。大多数体外细胞培养的数据以及
FA患者能通过BMT治愈,提示
FA的再生障碍是多能干细胞的缺陷。造血组织是对放射和细胞毒性治疗引起的DNA损伤最敏感的组织之一。其他的DNA修复障碍性疾病,如
着色性干皮病或
共济失调-毛细血管扩张症,发生恶性肿瘤的危险增加,但没有与
FA同样高的骨髓衰竭的发生率。提示
FA蛋白在造血干细胞的维持中起了特别关键的作用,并且牵涉到
FA途径的不同功能的联合。引起骨髓衰竭的造血干细胞的最初的衰退,可能是由于端粒维持缺陷及高凋亡率,随后,在基因不稳定的基础上,由于细胞因子信号环境的改变,选择压力促使突变克隆的产生,导致了MDS和AML。
体内及体外培养均观察到
FA患者细胞因子产生的异常,血浆中肿瘤坏死因子-α(TNF-α)的水平增加,而干扰素-γ没有增加。
FA淋巴细胞或成纤维细胞产生的白介素-6(IL-6)减少,加入IL-6可以修正MMC的细胞毒性。患者的淋巴细胞过度的产生TNF-α,加入IL-6减少TNF-α的过度产生,TNF-α抗体降低了对MMC的敏感性。SCF的产生正常或减低,而GM-CSF和G-CSF的产生无规律性,可减少或增高。
 临床表现
临床表现
临床表现:
1.原发性Fanconi综合征 是一种常染色体隐性遗传疾病,诊断时的平均年龄男性是6.5岁,女性是8岁。发病年龄范围从出生到48岁。男女比例1.2∶1。发病无种族或地区差异,一家中可有兄弟姐妹多人发病。早期患者的诊断是在
再生障碍性贫血(白血病或肿瘤)发生时做出的;最近认为,患者的同胞有阳性的染色体断裂或有特征性躯体异常,就诊者即使没有贫血也可以做出
FA的诊断。
FA为一综合征,临床表现主要包括3方面:骨髓衰竭、各种发育异常和肿瘤易感性增加。
(1)Alter分型:根据血液学特点,Alter等于1991年把
FA分为6个临床亚型:
④中、重度
再生障碍性贫血,不依赖输血,未接受雄激素治疗或雄激素治疗无效。
⑤有骨髓衰竭的特征,如轻度贫血、粒细胞减少、血小板减少;大红细胞,HbF增高。病情稳定,不需输血和雄激素治疗。
⑥血象正常,HbF正常或轻度异常,不需输血和雄激素治疗。
(2)表现特点:本病临床表现取决于肾小管功能障碍的类型和程度。全氨基酸尿、糖尿以及高磷酸盐尿导致低磷血症为本症的三大特征,但不完全性Fanconi综合征不是全部具备上述3个特征,往往只具备其中1、2项。
①婴儿型:也称急性型,特点有:
A.起病早,6~12个月发病。
B.常因烦渴、多饮、多尿、
脱水、消瘦、呕吐、
便秘、无力而就诊。
C.生长迟缓、发育障碍,出现抗维生素D
佝偻病及营养不良、骨质疏松甚至骨折等表现。
D.肾性全氨基酸尿,但血浆氨基酸正常。
E.低血钾,低血磷,碱性酸酶活性增高,高氯血症性
代谢性酸中毒,尿中可滴定酸及NH
4 可减少,尿糖微量或增多,血糖正常。
F.预后较差,可死于尿毒症性酸中毒或继发感染。
②幼儿型:起病较晚(2岁以后),症状较婴儿型轻,以抗维生素D
佝偻病及生长迟缓为最突出表现。
③成人型:特点有:
A.10~20岁或更晚发病。
B.多种肾小管功能障碍;如糖尿、全氨基酸尿、高磷酸盐尿、低血钾、高氯酸中毒。
D.晚期可出现肾功能衰竭。
(3)血液学异常:
FA最重要的临床特征是血液学异常,
FA是遗传性骨髓衰竭综合征最常见的类型,AA、MDS和AML在纯合子的发生率都显著增加。患者出生时的血细胞计数是正常的,最早被检测到的异常是大红细胞症,随后出现血小板减少和中性粒细胞减少。40岁以前出现血液学异常的概率是98%,最常见的血液学异常是血小板减少和全血细胞减少,与骨髓增生低下有关。53%的患者以全血细胞减少发病,38%的患者以血小板减少发病,随访20年后有84%的患者发展为全血细胞减少,少部分患者以贫血、中性粒细胞减少发病,部分患者发病时即为骨髓增生异常综合征(MDS)或急性白血病(尤其是急性髓系白血病)。临床上,
FA患者有出血、苍白和(或)反复感染。
(4)其他表现:身材矮小的
FA患者28例检测了生长激素(GH)水平,有22例GH缺乏,GH激素治疗15例患者有12例长高,无一例患者造血改善,GH治疗的患者中一例死于急性髓系白血病。最近报道44%的患者有GH缺乏,36%的患者有甲状腺功能减低。重组GH在生长和造血中的作用还需要进一步观察,而且GH治疗和白血病之间的可能联系需要仔细探讨。
2.继发性Fanconi综合征 因病因不同,表现有所不同。
 鉴别诊断
鉴别诊断
鉴别诊断:
2.血小板减少症-桡骨缺失综合征(TAR) 是一种常染色体隐性遗传性疾病,在出生时或新生儿期出现血小板减少伴有桡骨缺失,但双侧拇指存在,没有血液系统恶性肿瘤或实体瘤增加的危险,与
FA不同。
3.
先天性纯红细胞再生障碍性贫血(
DBA) 是以红系祖细胞成熟缺陷为特征,1岁以内出现正细胞或大细胞性贫血,1/3以上的患者有先天畸形,常累及头部(小颌,
唇裂)、上肢和泌尿生殖系统。大多数患者为散发,少数为常染色体显性或隐性遗传。
以上3种疾病的DEB/MMC试验无染色体断裂增加,可与
FA鉴别。
4. Nijmegen断裂综合征 是一种罕见的常染色体隐性遗传性疾病,由NBS1突变引起,以免疫缺陷、小头畸形和对电离辐射超敏为特征,大多数患者是南斯拉夫人。最近的一个研究中,8个俄国的NBS患者,3个有造血异常或AML,因此,临床上与
FA非常相似。如果诊断困难可以考虑进行NBS突变检查。
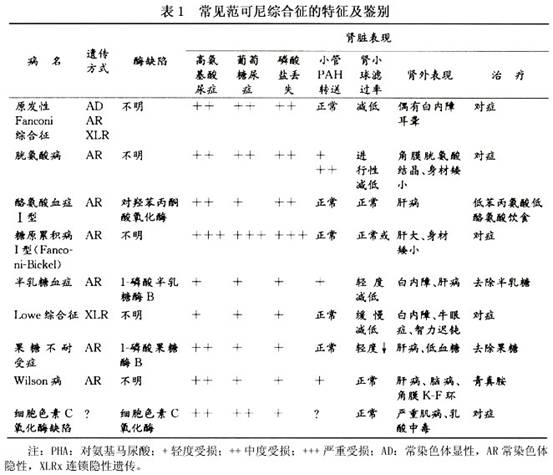
表1为各种不同病因下Fanconi综合征的特点和区别。
 治疗
治疗
治疗:
1.病因治疗 对代谢缺陷类型已被认识的继发性Fanconi综合征,可进行特异性治疗。通过饮食疗法减少或避免有毒代谢产物积聚的疾病有半乳糖血症、遗传性果糖不耐受、酪氨酸血症Ⅰ型。通过促进排泄治疗的疾病有Wilson病和重金属中毒。由药物引起的Fanconi综合征,清除体内药物可纠
正肾小管功能障碍。坚持、恰当地进行特异性治疗,可使患者完全恢复正常。对于由肾脏疾病或全身疾病后引起的Fanconi综合征则相应针对原发病治疗。
2.对症治疗
(1)纠正酸中毒根据肾小管受损的程度给予碱性药物,剂量2~10mmol/(kg·d),可采用碳酸氢钠或者
枸橼酸钠钾合剂,全天剂量分4~5次口服,然后根据血中HCO
3- 浓度调整剂量。应注意同时补钾,如碱性药物用量过大,可合用氢氯噻嗪,促进HCO
3-回吸收。
(2)纠正低磷血症:口服中性磷酸盐以纠正低磷血症,剂量为1~3g/d,分次服,每4~5小时用药1次,不良反应有胃肠不适和腹泻,减少用量可减轻上述症状。在部分患者,应用磷酸盐可加重低钙血症,诱发甲状旁腺功能亢进,可口服钙剂和维生素D预防。中性磷酸盐配方:Na2HPO4·7H2O 145g,Na2HPO4·H2O 18.2g,加水至1000ml,每1000ml供磷2g。
(3)其他:应补充血容量,防脱水,纠正低钾血症。对于低尿酸血症、氨基酸尿、糖尿及蛋白尿,目前尚缺乏有效的治疗方法。肾功能不全者,则酌情采用保守式肾脏替代治疗。
FA的治疗主要针对其血液学改变以及危及生命的各种并发症。
3.雄激素和皮质类固醇激素治疗 当FA患者发生全血细胞减少时,治疗主要是雄激素和支持治疗。雄激素可增加EPO的产生,刺激红系干细胞,从而提高血红蛋白水平。约75%的患者雄激素治疗有效,雄激素起效最早的表现是出现大红细胞以及HbF水平增加,开始治疗后2~3个月血红蛋白开始上升,随后血小板计数上升,最后中性粒细胞上升,要确定雄激素是否有效至少要坚持用药6个月以上。有效时间可持续几个月至20年不等。几乎所有的患者停用雄激素后复发,仅少数治疗时小于12岁的患者,在青春期时可停止治疗而不复发。最终许多患者对所用的雄激素耐药,换用另外一种雄激素少部分患者可能有效。由于雄激素的应用,延长了患者的生存期,但一些患者可能出现肿瘤等晚期并发症。
单独应用雄激素与雄激素加皮质类固醇激素的疗效相同,但一般推荐联合治疗,皮质类固醇激素引起的生长迟缓可抵消雄激素使生长加速的副作用,也可以通过降低血管的通透性减少出血。最常用的雄激素是司坦唑(康力龙),口服0.1mg/(kg·d),泼尼松(强的松)5~10mg,隔天1次。为降低肝脏毒性可用雄激素注射剂,苯丙酸诺龙(长效多乐宝灵)1~2mg/(kg·周),肌内注射,为预防血肿,可用冰袋冷敷和按压。
雄激素的副作用有女性男性化,多毛症以及声音变粗,外生殖器肥大,痤疮,情绪不稳,水、钠潴留,体重增加,肌肉发达,由于骨骼成熟加速致骨骺过早融合,最终导致身材矮小。这些副作用中部分在雄激素减量或停用后消失。比较严重的副作用包括肝大、胆汁郁积性黄疸和肝功能中转氨酶水平上升,但这些是可逆的。最严重的问题是肝紫癜、肝腺瘤和肝细胞癌,但这些在雄激素治疗停止后也能恢复。接受雄激素治疗的患者需定期进行肝生化检查和超声检查,治疗有效的患者可逐渐减量但不能停药。但有些患者雄激素可停用,这些患者可能有血液系统镶嵌现象,其“正常”干细胞有选择性造血优势。
4.细胞因子 造血生长因子如非格司亭(G-CSF)和莫拉司亭(GM-CSF)、能改善造血,特别是中性粒细胞减少的患者,能增加中性粒细胞绝对值,仅少数患者血红蛋白和血小板计数增加。可与雄激素联合应用或用于雄激素治疗无效的患者。然而,这些因子的应用也能使肿瘤易感的患者发生白血病或促使向MDS或7号染色体单体演化,因此仅用于严重中性粒细胞减少的患者,慎用于有克隆性细胞遗传学异常的患者,并注意监测外周血细胞计数,定期行骨髓检查和骨髓细胞遗传学检查,一旦发现异常应停用。
5.造血干细胞移植 造血干细胞移植是惟一能治愈FA患者的措施,也可以预防白血病的发生。HLA相合的同胞供者异基因骨髓移植,两年生存率可达到66%;无HLA相合的同胞供者可选择HLA相合的无关供者或不匹配的家族成员,但移植效果很差,两年生存率仅29%。HLA相合的同胞脐带血移植已有成功的报道,但需行着床胚胎遗传学诊断,以确定胚胎无FA倾向且与患者HLA相合。为获得HLA相合的同胞脐带血,需多次尝试,造成了大量的无FA倾向但HLA不相合的胚胎的浪费,这在伦理学上是有争议的。无关脐带血移植效果差。
由于FA患者对放疗和预处理方案药物如环磷酰胺(CTX)超敏,可发生严重的黏膜炎伴有肠道吸收障碍和出血、液体潴留、心功能衰竭及出血性膀胱炎。减少环磷酰胺(CTX)的剂量到20mg/kg,分4天给药,加5Gy的胸腹部放疗,这个方案的累积生存率大约是70%。应用
氟达拉滨进行预处理,代替放疗取得了更好的疗效。尽管骨髓移植是一种有效的治疗措施,但化疗和放疗增加了发生第二肿瘤的危险(尤其是头颈部肿瘤)。
6.基因治疗 FA前体细胞和肝细胞的基因转导可以从遗传学上纠正所有系统的造血细胞异常,恢复正常的持续造血。在FAA和
FAC患者的体外试验中均已获得成功,是目前FA基因治疗的依据所在。应用反转录病毒介导的基因转移,矫正FANCC敲除的小鼠对MMC的高敏性,已有成功的报道。在人类应用反转录病毒载体的临床试验还未成功,但最近用慢病毒载体在敲除了基因的小鼠取得了较好的结果,应用少量的病毒就能获得有效的转导,不需要预先应用细胞因子而且体外操作极少,因此用于人类的治疗可能比反转录病毒更成功。
7.其他治疗 合并再生障碍性贫血的FA患者均需要支持治疗。有出血的患者,可用
氨基己酸0.1g/kg,每6小时服用1次。有可能进行移植治疗的患者,应避免输注来自家族成员的血液制品,以减少移植时过敏的可能。过滤了白细胞的血液制品可减少输血反应和对白细胞过敏。避免接触可引起获得性再生障碍性贫血的药品和化学物质。血小板减少的患者避免应用影响血小板功能的药物。脾切除术只用于巨脾的患者,对长期预后没有明显的益处。大剂量的甲泼尼龙(甲基强的松龙)、
抗胸腺细胞球蛋白和环孢素曾用于FA患者的治疗,但缺乏疗效。FA继发AML的治疗困难,预后差。由于D
NA修复缺陷,对化疗敏感性增加,因此化疗相关毒性增加,化疗剂量应减少。抗氧化剂治疗亦有报道,但在尝试中。



 流行病学
流行病学
 病因
病因
 发病机制
发病机制
 临床表现
临床表现
 并发症
并发症
 实验室检查
实验室检查
 其他辅助检查
其他辅助检查
 诊断
诊断
 鉴别诊断
鉴别诊断
 治疗
治疗
 预后
预后
 预防
预防